Dieci punti fermi
Se leggete questa pagina, è molto probabile che voi o qualcuno che conoscete abbia il sospetto, o sappia, di avere un tumore del seno.
Allora darò subito dieci punti fermi, che vi invito a consultare ogni volta che avete dubbi o che siete prese dallo sconforto.
Primo: il tumore del seno può essere curato.
Secondo: prima lo si scopre, meglio lo si cura.
Terzo: il tumore del seno può essere scoperto prima che voi vi accorgiate di qualcosa.
Quarto: il tumore del seno di solito non provoca dolore.
Quinto: nella maggior parte dei casi i noduli del seno sono benigni.
Sesto: per saperlo dovete rivolgervi SUBITO ad uno specialista senologo.
Settimo: fare accertamenti non vuol dire avere il tumore, ma consente di essere tempestivi ed efficaci nella cura.
Ottavo: le scorciatoie non esistono, e chi le propone è solo un truffatore.
Nono: in tutto il mondo gli scienziati concordano sulle modalità di trattamento del tumore del seno.
Decimo: la medicina non è questione di fede o di mode, ma è una scienza che richiede studio, applicazione ed esperienza.
Adesso, chi vuole può approfondire leggendo qui.
1. Il seno
Il seno è costituito da due organi (mammelle) che contengono ciascuna una ghiandola mammaria. Queste ghiandole sono molto attive nel corso della vita della donna e vanno naturalmente incontro a modificazioni cicliche, sotto l’influsso degli ormoni sessuali femminili.
A loro volta, le ghiandole sono composte da unità, dette lobuli, che sono come grappoli d’uva: sono costituite da acini che producono il latte e da dotti che lo fanno scorrere fino ai capezzoli.

Poiché la funzione naturale di queste ghiandole è produrre latte per i cuccioli, l’allattamento al seno ha una funzione protettiva: infatti, consente la completa maturazione delle cellule delle ghiandole mammarie.
2. Il tumore del seno (TDS)
Quando alcune cellule delle ghiandole mammarie sbagliano a replicarsi, possono perdere la capacità di riconoscersi come parte di un organo e invadono lo spazio che le circonda, dando luogo al tumore.
Crescendo, il tumore assume in genere una forma tondeggiante (nodulo), ma tende a superare i limiti della ghiandola e, nel tempo, le cellule tumorali si staccano e migrano nell’organismo (metastasi).
La migrazione delle cellule tumorali avviene principalmente attraverso i dotti linfatici, ma anche il sistema venoso può essere coinvolto e trasportare a distanza le cellule maligne e le loro progenitrici (cellule staminali cancerose).
Le metastasi ad organi distanti si sviluppano da queste cellule migrate: le terapie con farmaci sono dirette ad eliminare le cellule migrate prima che si moltiplichino in modo preoccupante.
3. Chi è più a rischio
In Italia vivono 380.000 donne curate per tumore al seno, ed ogni anno vengono scoperti e curati circa 40.000 nuovi TDS. Per dare un’idea delle dimensioni del problema, Bologna ha 381.000 abitanti e Alghero ne ha 40.000.
Esistono delle condizioni (fattori di rischio) che predispongono al TDS: per alcune si può intensificare la sorveglianza, ma altre possono addirittura essere eliminate.
Età: il rischio di ammalare di TDS aumenta con l’età. Sono più frequenti tra le donne di più di 50 anni in menopausa. Infatti, 8 su dieci TDS colpiscono donne over 50. Per questo in Lombardia si effettua lo screening mammografico gratuito nelle donne tra i 50 e i 70 anni.
Storia familiare: se avete parenti stretti che hanno o hanno avuto TDS (anche maschi!) o tumore delle ovaie, potreste correre un rischio più elevato del normale anche voi.
Ereditarietà: la massima parte dei TDS non sono ereditari, cioè non vengono trasmessi da madre o padre a figlia. Tuttavia, esistono alcuni geni, conosciuti come BRCA-1 e BRCA-2, che aumentano il rischio di ammalare sia di TDS che di tumore dell’ovaio e possono essere ricevuti dai genitori e trasmessi ai figli. Lo studio genetico, però, è indicato in pochi casi. Perciò è opportuno consultare il senologo.
Diagnosi precedente di tumore del seno: se siete già state curate per un TDS, anche per una forma estremamente precoce (carcinoma duttale in situ), correte un rischio maggiore del normale di sviluppare un nuovo TDS, sia nella stessa mammella che nell’altra.
Diagnosi precedente di nodulo mammario benigno: alcuni tipi di noduli benigni possono aumentare un po’ il rischio di sviluppare TDS. Per esempio, quelli che dimostrano modificazioni benigne delle cellule dei dotti, che si accrescono in modo anormale (iperplasia duttale atipica), oppure cellule dei lobuli ghiandolari degenerate (carcinoma lobulare in situ).
Densità delle ghiandole mammarie: la consistenza delle ghiandole mammarie è maggiore rispetto al grasso ed al tessuto di sostegno per il maggior contenuto di cellule e ciò le rende più dense. Le donne con ghiandole più dense possono avere un rischio maggiore di TDS perché le loro ghiandole contengono un numero maggiore di cellule che possono degenerare.
Questa maggiore densità può anche ostacolare l’interpretazione delle mammografie.
Le donne più giovani hanno ghiandole con un maggior contenuto in cellule, quindi più dense; con l’avanzare dell’età parte delle cellule ghiandolari viene sostituita da cellule adipose (grasso) e la densità della ghiandola diminuisce.
Esposizione agli estrogeni: gli estrogeni sono ormoni femminili normalmente prodotti dalle ovaie a partire dalla pubertà e determinano le modificazioni tipiche del corpo femminile (sviluppo degli organi sessuali, ciclo mestruale, distribuzione dei peli e del grasso, voce, ecc.) tra cui anche la comparsa del seno. In molti casi le cellule cancerose del TDS possono essere stimolate a moltiplicarsi dagli estrogeni. Perciò un prolungato periodo fertile (pubertà precoce e menopausa tardiva) espone le cellule delle ghiandole mammarie ad una prolungata stimolazione da parte degli estrogeni, che può favorire l’insorgenza del TDS.
Analogamente, non avere avuto figli (nulliparità) o averli avuti in tarda età può aumentare leggermente il rischio di TDS perché l’esposizione agli estrogeni non viene interrotta dalle gravidanze.
Sovrappeso e obesità: essere sovrappeso o decisamente obese in menopausa aumenta il rischio di TDS perché la produzione di estrogeni, cessata nelle ovaie, prosegue in una certa misura nel tessuto adiposo (cioè nel grasso) in eccesso.
Altezza: le donne più alte della media hanno un rischio maggiore di TDS rispetto a quelle più basse della media. La ragione è sconosciuta, ma il dato è confermato dalle statistiche.
Alcool: il rischio di sviluppare TDS aumenta con il consumo di bevande alcoliche. Il consumo di soli due drinks al giorno aumenta il rischio di quasi due punti percentuali rispetto a chi non beve alcolici.
Radiazioni: l’esposizione a radiazioni in età prepuberale e adolescenziale aumenta il rischio di TDS. Questo vale soprattutto per le bambine e ragazze sottoposte a radioterapia al torace (p. es. per M. di Hodgkin, linfomi o leucemie), che devono seguire in età adulta un protocollo di screening mammario particolare.
Anche l’uso di radiazioni per scopi di diagnosi (Rx torace, TAC) deve essere tenuto in considerazione, per non eccedere nella dose totale di radiazioni assorbite.
Terapia ormonale sostitutiva: per attenuare o ritardare gli effetti spiacevoli della menopausa, può essere indicata l’assunzione di una terapia ormonale sostitutiva, sia con soli estrogeni, sia con una combinazione di estrogeni e progestinici. Queste terapie aumentano il rischio di TDS tanto più quanto più a lungo si protraggono. Il rischio torna a livello normale quando queste terapie vengono interrotte.
4. La diagnosi di tumore del seno
Fare diagnosi di tumore del seno in fase avanzata non è difficile.
L’obiettivo, però, è ottenere una diagnosi quanto più precoce possibile, perché ciò garantisce il massimo delle possibilità di guarigione.
Il dolore non è di grande aiuto, sia perché normalmente non si associa al TDS, sia perché è parte della sindrome premestruale (i disturbi che si manifestano immediatamente prima del mestruo e spesso lo accompagnano) e caratterizza più spesso la displasia fibrocistica della mammella, situazione benigna, ancorché fastidiosa, e piuttosto frequente.
Ciò a cui dobbiamo porre attenzione sono soprattutto le variazioni di forma e colore della pelle della mammella, la presenza di eczemi del capezzolo e dell’areola (soprattutto se da un solo lato), la comparsa di secrezioni dal capezzolo (chiare o macchiate di sangue), la retrazione di un capezzolo che prima era normalmente estroflesso, la presenza di un nodulo che non era mai stato notato prima o di un nodulo già noto che si ingrandisce, affossamenti o protuberanze della cute di una mammella, la comparsa di “pelle a buccia d’arancio”.
Ricordando che il TDS può colpire a qualsiasi età dopo la pubertà, è utile che ogni donna abbia chiaro che la prevenzione e la diagnosi partono da se stessa.
5. Autoesame
L’autoesame comincia ponendosi in piedi davanti ad uno specchio a torace nudo ed osservando la simmetria delle mammelle, la regolarità dei contorni, la forma e la colorazione dei capezzoli e delle areole.
L’osservazione va eseguita prima con le braccia lungo il corpo, poi con le braccia sollevate al di sopra della testa, di fronte e di profilo:

La seconda parte dell’autoesame consiste nell’autopalpazione.
Questa si esegue sia in posizione eretta che in posizione supina.
Il braccio del lato da esaminare va portato al di sopra della testa.
Con l’altra mano, a dita unite, si passa delicatamente su tutta la mammella in modo sistematico. Si può procedere in modo circolare, dall’areola con movimenti concentrici fino a raggiungere la periferia; oppure partendo dalla periferia e facendo scorrere le dita verso l’areola più volte, in modo da controllare tutti i settori della mammella; oppure si può procedere dall’alto in basso e dal basso in alto, lungo l’asse del corpo, più volte, fino a controllare ogni settore della mammella.
La stessa operazione deve essere ripetuta per l’altra mammella.
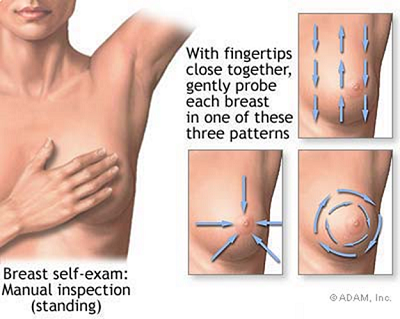
L’autopalpazione deve poi essere ripetuta con le stesse modalità, ma in posizione supina, sempre col braccio del lato da esaminare al di sopra della testa.

Dai 20 anni in poi, l’autoesame dovrebbe essere eseguito ogni due mesi, con regolarità, due o tre giorni dopo il termine delle mestruazioni, quando le mammelle sono tornate del volume normale.
Anche se non si trovano anomalie, è consigliabile una visita senologica una volta all’anno.
6. Se c’è un nodulo
La presenza di un nodulo nelle mammelle è molto frequente e la maggior parte delle volte si tratta di una situazione benigna (cisti, fibroadenomi).
Tuttavia, la più frequente delle modalità di presentazione del TDS è proprio la scoperta, da parte della donna, di un nodulo.
Ogni nodulo di nuovo riscontro deve essere sottoposto al più presto alla valutazione del chirurgo esperto di senologia, che saprà proporre gli approfondimenti più opportuni e predisporre l’iter più corretto.
La cosa più importante è la definizione della natura (benigna o maligna) del nodulo.
La diagnosi
Si affida a diversi mezzi: anzitutto la visita senologica, che può dare una quantità di informazioni utili, altrimenti non rilevabili.
Quindi, gli esami strumentali (ecografia, mammografia, risonanza magnetica): ognuno di questi fornisce una sorta di punto di vista. L’integrazione di più punti di vista porta frequentemente ad una diagnosi sufficientemente precisa.
Esami più invasivi (agoaspirato, agobiopsia, biopsia escissionale) permettono la raccolta di materiale biologico che può essere esaminato al microscopio.
7. Se il nodulo è maligno
La diagnosi di malignità del nodulo impone il ricorso a un programma di terapia complesso, alla cui progettazione contribuiscono, assieme alla paziente, numerosi specialisti; l’impegno collegiale di tutte le figure professionali necessarie consente di offrire alla paziente la soluzione migliore, ritagliata sulle caratteristiche particolari del tumore e della paziente stessa.
Un passo dopo l’altro la paziente verrà guidata e assistita lungo un percorso non facile, ma che consentirà di riacquistare lo stato di salute e la fiducia in se stessa.
Attualmente, la base di partenza della terapia del TDS è l’intervento chirurgico di asportazione della parte di ghiandola malata, con l’esame del linfonodo sentinella, e un ciclo di radioterapia sulla porzione di ghiandola mammaria rimasta. La sigla usata è QUART + BLS (quadrantectomia, radioterapia + biopsia del linfonodo sentinella).
Lo scopo è di asportare il tumore e le eventuali cellule migrate nei linfonodi dell’ascella, e di uccidere con le radiazioni ogni residuo di cellule maligne eventualmente presente nella porzione di ghiandola rimasta, con il minimo sacrificio possibile. Si è, infatti, visto che un intervento limitato dà le stesse garanzie di guarigione che erano assicurate dagli interventi molto demolitivi in uso fino a non molti anni fa.
Perché una quadrantectomia sia eseguibile, è necessario che il tumore abbia delle caratteristiche di crescita adatte e delle dimensioni adatte. L’intervento deve, perciò, essere molto personalizzato.
8. Il linfonodo sentinella
Quando le cellule tumorali cominciano a migrare, seguono preferenzialmente la via dei linfatici dell’ascella.
Lungo questo percorso, incontrano un primo linfonodo: si è dimostrato che, se questo linfonodo è indenne da cellule tumorali, anche il resto dei linfonodi dell’ascella è libero, perciò non è necessario proseguire l’intervento con l’asportazione di tutti i linfonodi ascellari.
Questo primo linfonodo è detto, appunto, linfonodo sentinella.
Alcune ore prima dell’intervento, nella cute al di sopra del tumore viene iniettato un liquido dotato di radioattività, che gradualmente si accumula nel linfonodo sentinella.
Nel corso dell’intervento, con l’aiuto di un detettore di raggi gamma, il chirurgo individua il linfonodo sentinella, lo asporta e lo invia in laboratorio. Qui il linfonodo viene esaminato al microscopio in un certo numero di sezioni sottili, alla ricerca delle cellule provenienti dal tumore.

Se non si trova un numero pericoloso di cellule maligne, il chirurgo termina l’intervento a questo punto.
Se, viceversa, il linfonodo è invaso da cellule maligne, il chirurgo asporta anche i rimanenti linfonodi ascellari (il numero totale va da 12-15 a 20-25), che poi verranno esaminati in laboratorio nei giorni successivi. Il risultato di questo esame dei linfonodi ascellari guiderà le successive terapie.
In questo modo, un grande numero di pazienti evita l’asportazione dei linfonodi dell’ascella, fatto che riduce il dolore postoperatorio ed elimina alcune complicanze fastidiose del cosiddetto svuotamento ascellare, come i sieromi e il linfedema del braccio.
La tecnica della biopsia del linfonodo sentinella non è praticata ovunque; inoltre, in taluni centri, viene eseguita in una seduta operatoria distinta, che precede di qualche giorno la quadrantectomia.
9. I tumori del seno non palpabili
La diffusione delle mammografie e delle ecografie come esami di screening ha consentito di riconoscere tumori piccolissimi, con diametri anche di tre soli millimetri, situati in profondità nel tessuto mammario.
Tumori così piccoli non sono palpabili dall’esterno, e la diagnosi di malignità può essere fatta con agoaspirato o agobiopsia guidati da opportune apparecchiature radiologiche stereotassiche, cioè in grado di guidare l’operatore in modo tridimensionale.
Ottenuta la diagnosi citologica (agoaspirato) o microistologica (agobiopsia), il piccolo tumore viene asportato chirurgicamente sulla guida di marcatori metallici, coloranti a persistenza prolungata o radioisotopi. L’avvenuta asportazione viene confermata dalla radiografia del pezzo rimosso.
10. La mammografia di screening
L’introduzione dei programmi di screening mammografico ha ridotto la mortalità per TDS del 20%.
La mammografia è ad oggi l’esame più adatto a sorprendere i TDS in fase molto precoce, e a consentire di intervenire in modo ancor più efficace. Le apparecchiature più moderne, i mammografi digitali, consentono di ottenere risultati massimi con una somministrazione di radiazioni molto limitata.
Solitamente i programmi di screening interessano le donne al di sopra dei 50 anni e fino ai 70, perché questa si è dimostrata la fascia d’età più a rischio. La frequenza è di una mammografia ogni due anni (Lombardia). Alcuni programmi di screening adottano periodicità differenti (UK: tre anni; USA: un anno ma su base volontaria).

Nelle donne a particolare rischio la periodicità della mammografia può essere ravvicinata e iniziata tra i 40 e i 45 anni, mentre per le età più giovani devono essere valutati caso per caso i provvedimenti e le periodicità più adatte.
La mammografia comporta la somministrazione di radiazioni, che sono un fattore di rischio per TDS; tuttavia, per aumentare di un millesimo il rischio di ammalare di TDS, occorre sottoporsi a 200 mammografie. Per confronto, la dose di radiazioni ricevute con una sola TAC equivale a 800 mammografie!
11. L’ecografia mammaria
La forma e la densità delle mammelle possono influenzare l’esecuzione e la nitidezza d’immagine della mammografia. Inoltre alcune condizioni sono poco definite dalla mammografia (per esempio le cisti, molto frequenti).
L’ecografia è un esame non invasivo e ripetibile in grado di contribuire a chiarire i dubbi che possono essere lasciati dalla mammografia e spesso viene associata a questo esame, come suo completamento.
L'ecografia è l'esame di elezione nelle donne giovani sintomatiche (al di sotto dei 35 anni) ed integra la mammografia in presenza di mammelle dense ai raggi X anche in età più matura.
Il limite maggiore dell’ecografia mammaria è la sua dipendenza dall’abilità dell’operatore.
12. Agoaspirato, agobiopsia, biopsia escissionale
Agoaspirato
E’ una procedura rapida per ottenere delle cellule dal nodulo sospetto ed esaminarle al microscopio.
Un ago normale montato su una siringa viene inserito nel nodulo mentre con la siringa si esegue l’aspirazione. L’ago viene mosso avanti e indietro in più direzioni prima di essere estratto. Il materiale così raccolto viene posto su vetrini, che verranno poi trattati e studiati al microscopio dallo specialista in anatomia patologica (esame citologico). Il risultato è disponibile in pochi giorni.
Da questo esame si può ottenere la conferma che il nodulo è maligno. Tuttavia il giudizio è dato su cellule e può non essere certo, soprattutto in caso di negatività.
Il referto dell’esame citologico è classificato secondo standard internazionali con delle sigle, cui corrisponde una diagnosi.
C1 = il materiale pervenuto non consente di porre diagnosi;
C2 = le cellule visibili sono certamente benigne;
C3 = le cellule visibili hanno qualche anomalia, ma sono probabilmente benigne;
C4 = le cellule visibili hanno caratteristiche probabilmente maligne;
C5 = le cellule dei campioni sono certamente maligne.
Nei casi non ben definiti (C3), il dato deve essere messo a confronto con gli altri esami effettuati (visita, ecografia, mammografia) per poter prendere una decisione.
Agobiopsia
E’ un esame più invasivo del precedente e consente di asportare una piccola porzione di nodulo, su cui si eseguirà un esame istologico e la tipizzazione dei recettori.
In anestesia locale e attraverso una incisione di 1-2 millimetri, viene introdotto nel nodulo un ago con una scanalatura in cui scorre una lama, che permette di asportare un frustolo di tessuto. Non sono necessari punti di sutura.
In questo modo la diagnosi è più precisa e sono possibili test e valutazioni che guideranno nella scelta dell’intervento chirurgico.
Biopsia escissionale
Lo scopo di questa procedura è asportare completamente il nodulo ed esaminarlo al microscopio in tutti i suoi aspetti. Inoltre è possibile tipizzare i recettori.
Oltre alla completezza e affidabilità della diagnosi, la biopsia escissionale offre il vantaggio che, in alcuni casi, l’asportazione totale del nodulo può rendere superfluo un intervento chirurgico più invasivo.
La biopsia si esegue in anestesia locale. Attraverso un’incisione della cute di 2-3 cm, il chirurgo isola il nodulo dal resto della ghiandola e lo asporta. Il pezzo viene poi inviato al laboratorio di anatomia patologica per essere studiato.
13. Il capezzolo
Un punto cruciale su cui si è concentrata l’attenzione dei chirurghi senologi è la conservazione del capezzolo e dell’areola.
Gli interventi conservativi hanno dimostrato che questo è possibile, ad eccezione del caso in cui il tumore interessa proprio la porzione di ghiandola subito dietro l’areola.
Il risparmio del complesso areola-capezzolo è anche conseguito nelle mastectomie “nipple sparing”, in cui, tuttavia, manca una esperienza su larga scala sufficientemente lunga per essere sicuri che non si abbia un tasso di recidive troppo elevato.
Quando non è possibile risparmiare il complesso areola-capezzolo, è generalmente possibile ricorrere ad accorgimenti chirurgici o estetici (tatuaggio) che consentono di ripristinare, in un secondo momento, un aspetto simile al normale di questa area.
Malattia di Paget
E’ il nome che viene dato alla localizzazione al capezzolo del tumore della mammella.
Si manifesta come eczema o ragade del capezzolo, che non guarisce con le normali creme idratanti ed antisettiche, anzi, tende ad estendersi.
Questa situazione deve essere trattata come gli altri TDS, sia dal punto di vista degli esami diagnostici, sia da quello del trattamento chirurgico, che, ovviamente, non potrà preservare il capezzolo.
14. Gli interventi chirurgici
Prima di un intervento chirurgico, è opportuno ottenere la diagnosi citologica o istologica: quando questo non è possibile, il primo atto dell’intervento deve essere l’invio di un campione al laboratorio per l’esame istologico estemporaneo: l’intervento può proseguire solo dopo la conferma istologica che si tratta di un tumore maligno.
Gli interventi chirurgici sono di due categorie: quelli che comportano la conservazione della mammella (interventi conservativi) e quelli che comportano l’asportazione di tutta la mammella (mastectomie).
Entrambe le categorie hanno intento radicale, cioè sono indirizzate a rimuovere totalmente la malattia locale.
Gli interventi conservativi, seguiti da radioterapia, hanno la stessa efficacia degli interventi ampiamente demolitivi in uso nel passato.
Durante un intervento conservativo, l’esame estemporaneo (nel corso dell’intervento) del pezzo, da parte dell’anatomopatologo, è necessario per stabilire se il tumore infiltra la ghiandola apparentemente sana: infatti, l’intervento deve essere radicale, cioè non lasciare tessuto tumorale.
La quantità di tessuto mammario che è necessario asportare dipende:
• dal tipo di tumore;
• dalle dimensioni e dalla posizione del tumore nell’ambito della mammella;
• dalla quantità di “margine libero” (ghiandola non infiltrata dal tumore) richiesta per la radicalità;
• dalle dimensioni della mammella.
Gli interventi conservativi e le mastectomie possono essere associati alla biopsia del linfonodo sentinella o alla linfoadenectomia ascellare (asportazione dei linfonodi dell’ascella).
Interventi conservativi
Tumorectomia
E’ un intervento limitato alla semplice asportazione della porzione di ghiandola che contiene il tumore, assieme ad una porzione di circostante di ghiandola non infiltrata. La cute può essere compresa nell’asportazione, se il tumore è molto superficiale.
E’ indicato in situazioni particolari, come i tumori a lenta crescita della quarta età o quando le caratteristiche biologiche del tumore lo consentono.
Quadrantectomia
Questo è attualmente l’intervento conservativo più praticato ed è stato messo a punto per la prima volta in Italia. E’ indicato nei tumori di piccole dimensioni, quali quelli individuati negli screening mammografici.
Consiste nell’asportazione di un ampio settore di ghiandola mammaria con la cute soprastante e la fascia del muscolo grande pettorale al di sotto della ghiandola. La quadrantectomia viene effettuata con un’incisione cutanea a losanga con asse maggiore radiale.
Per i tumori posti subito dietro l’areola (retroareolari), è necessario asportare un cilindro di tessuto comprendente l’areola, il tumore e la fascia del muscolo pettorale.
L’asportazione del parenchima mammario deve includere i dotti galattofori compresi fra il tumore e il capezzolo.
Perifericamente è sufficiente un margine di 2 cm.

Mastectomie
Mastectomia sottocutanea
L’intervento prevede l’asportazione dell’intera ghiandola mammaria preservando la cute della mammella e il complesso areola-capezzolo. Le incisioni cutanee di solito praticate sono la sottomammaria o la trasversale, perché consentono i risultati estetici migliori. In molti casi può essere associato alla plastica additiva (con posizionamento di una protesi al di sotto del muscolo pettorale).
Mastectomia con risparmio cutaneo (skin sparing mastectomy)
Questo intervento prevede l’asportazione della ghiandola mammaria con il complesso areola-capezzolo rispettando completamente o in parte la cute soprastante. E’ indicato quando il tumore è collocato dietro l’areola o la comprende.
La conservazione del solco sottomammario facilita molto la successiva ricostruzione.
Mastectomia con risparmio del capezzolo (nipple-sparing mastectomy)
Da qualche anno si è cominciato a eseguire la mastectomia nipple-sparing, che prevede la conservazione dell’areola e del capezzolo con l’irradiazione di questo complesso anatomico con elettroni. La radioterapia può essere erogata intraoperatoriamente (cosiddetta IORT, intraoperative radiotherapy) oppure nei giorni successivi all’intervento. Non tutti i chirurghi che si occupano del cancro della mammella sono concordi sulla sicurezza oncologica di questa tecnica.
Requisito importante per la conservazione del complesso areola-capezzolo è la negatività microscopica intraoperatoria per neoplasia del tessuto retro-areolare. Deve, quindi, essere eseguito l’esame microscopico di un frammento di tessuto dei dotti galattofori durante l’intervento stesso.
Possono beneficiare di questo tipo di intervento pazienti affette da tumori estesi al quadrante retroareolare che però non infiltrano i dotti galattofori al di sotto dell’areola, oppure tumori infiltranti estesi, ma situati in sedi distanti dalla zona centrale della mammella.
Mastectomia totale (o semplice)
Consiste nell’asportazione della ghiandola mammaria e di un’ampia losanga di cute soprastante, comprendente areola e capezzolo.
L’incisione cutanea, a losanga, può avere l’asse maggiore orizzontale o obliquo.
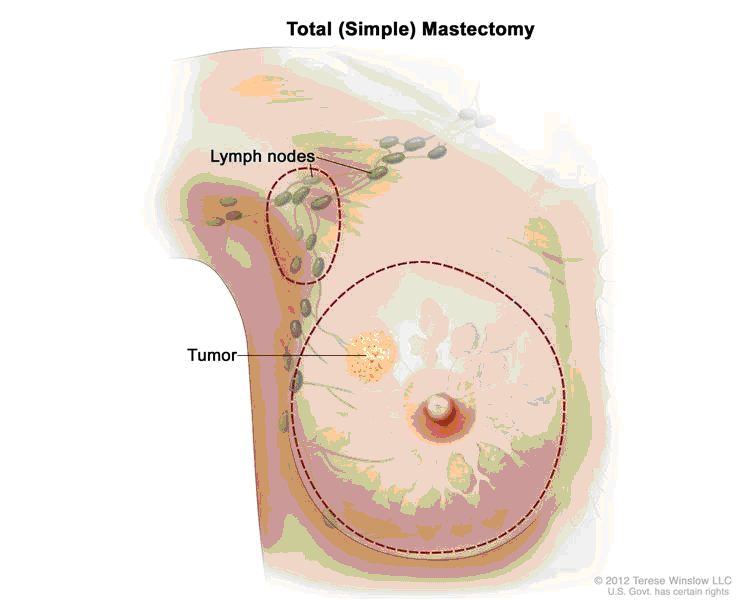
Ne risulta un intervento molto invalidante, che è riservato a casi molto particolari, con ampia diffusione locale del tumore (locally advanced breast cancer).
15. I linfonodi dell’ascella
La linfa che proviene dalla mammella viene filtrata da un sistema di linfonodi collocato nell’ascella. Per questo motivo le cellule tumorali che migrano attraverso il sistema linfatico vengono preferenzialmente concentrate nei linfonodi dell’ascella.
Lo studio di questi linfonodi è un punto importante nel trattamento del cancro della mammella, perché consente di calibrare meglio sia la radoterapia che la chemioterapia e le altre terapie farmacologiche. Inoltre consente di definire lo stadio della malattia e di prevedere la possibilità di recidive e, in certa misura, anche la sopravvivenza.

Studi pluridecennali hanno dimostrato che l’asportazione dei linfonodi dell’ascella invasi dal tumore (linfoadenectomia ascellare) riduce drasticamente la possibilità di recidiva del cancro della mammella all’ascella, con un notevole miglioramento del controllo locale della malattia, che può tradursi anche in un vantaggio in termini di maggiore sopravvivenza.
Le persone che hanno un cancro della mammella che ha già dato sintomi (per esempio, la presenza di un nodulo palpabile), anche quando sono in fase precoce, hanno dal 30 al 40% di probabilità di avere i linfonodi ascellari invasi; questa probabilità è sensibile (20-25%) anche in chi scopre un tumore della mammella, senza avere sintomi, durante un programma di screening.
Tuttavia, se la linfoadenectomia ascellare fosse eseguita sempre, risulterebbe inutile in più della metà dei casi. Per questo motivo è stata introdotta la tecnica del linfonodo sentinella, che consente di escludere che i linfonodi ascellari siano invasi dal tumore, se questo linfonodo non presenta cellule maligne.
Attualmente la linfoadenectomia ascellare è indicata nei casi in cui:
• il linfonodo sentinella risulti massicciamente invaso da cellule tumorali;
• i linfonodi dell’ascella siano interessati dal tumore già prima dell’asportazione del tumore della mammella;
• sia necessario ridurre il volume di tessuto tumorale da trattare con chemio o radioterapia per rendere possibile l’asportazione di un cancro della mammella in stadio avanzato.
La complicazione più frequente della linfoadenectomia ascellare è il linfedema dell’arto superiore, perché anche la linfa proveniente dall’arto superiore viene filtrata da un gruppo di linfonodi dell’apice dell’ascella. Il linfedema può essere curato, ma non è frequente la completa guarigione e può essere necessario sottoporsi a terapie continuative per ridurne gli effetti negativi.
La “bonifica” dei linfonodi ascellari, quando il linfonodo sentinella è positivo, può essere conseguita anche con l’irradiazione dell’ascella, con risultati analoghi alla linfoadenectomia: il linfedema è meno frequente in questi casi, ma può svilupparsi anche a distanza di molti mesi dal termine della radioterapia.
16. L’esame istopatologico
E’ un momento molto importante sia per la diagnosi che per il trattamento del tumore della mammella.
Durante l’intervento l’esame estemporaneo consente di confermare la diagnosi di tumore maligno, di stabilire se sono stati rispettati i margini di sicurezza richiesti, eventualmente correggendoli, di stabilire se il linfonodo sentinella è invaso da cellule tumorali e, quindi, se è necessario eseguire la linfoadenectomia ascellare.
L’esame definitivo al microscopio consente di precisare il tipo di tumore, la sua aggressività (o grado di differenziazione), se le strutture vascolari sono invase e in che misura, quanti linfonodi dell’ascella sono invasi e quanti non lo sono.
L’esame istopatologico viene poi completato da indagini immunoistochimiche, che consentono di identificare la presenza sulle cellule tumorali di recettori per gli ormoni estrogeni e progestinici, che rappresentano un possibile punto di attacco delle successive terapie.
Attraverso questi ulteriori esami, si stabilisce anche la capacità di proliferazione delle cellule tumorali e la presenza del recettore Her2/neu, che ha una frequenza del 25% dei tumori della mammella, e su quante cellule tumorali si trova.
Tutte queste informazioni consentono non solo di precisare la diagnosi, ma anche di proporre una terapia personalizzata, sia per ciò che riguarda il tipo di farmaci che l’intensità di cura, in modo da assicurare a quella precisa persona il massimo di probabilità di guarire con il minimo di effetti collaterali.
A queste fondamentali informazioni, verranno poi aggiunte quelle fornite dalle successive indagini cliniche, come la scintigrafia ossea, l’ecografia dell’addome e la radiografia del torace, per stabilire lo stadio in cui si trova la malattia e organizzare il piano delle cure e dei controlli periodici.
17. La radioterapia (RT)
La radioterapia fa parte delle armi che abbiamo a disposizione per combattere il TDS: consiste nel somministrare dosi controllate di radiazioni nell’area sottoposta all’intervento chirurgico, con lo scopo di uccidere tutte le cellule tumorali che possono essere sfuggite.
Di solito viene somministrata un mese dopo l’intervento chirurgico e l’eventuale chemioterapia.
Le sessioni di RT sono brevi (pochi minuti), ma devono essere ripetute per 3-5 giorni la settimana per 3-6 settimane. Inoltre, gli schemi più in uso prevedono un’irradiazione specifica ed aggiuntiva della zona sottoposta all’intervento chirurgico. La frequenza e l’intensità della RT sono decise dal radiologo in base al tipo di tumore e al tipo di intervento chirurgico.
L’oncologo deciderà, invece, se la RT è opportuna o superflua: infatti, in alcuni casi particolari non viene eseguita.
La RT può interessare la mammella residua dopo un intervento conservativo, la parete toracica dopo mastectomia, i linfonodi dell’ascella e delle stazioni (gruppi di linfonodi) limitrofe.
Una modalità particolare di somministrazione è la “boost radiotherapy” (RT ad impulsi), che consiste nell’irradiare la mammella operata con impulsi ad alte dosi di radiazioni. Questo permette di abbreviare il ciclo di RT, ma la mammella può risultare deformata o indurita (fibrosi attinica), soprattutto se di grosse dimensioni.
Nel tentativo di ridurre la durata della RT, è stato proposto l’uso della radioterapia intraoperatoria (IORT), cioè le radiazioni vengono somministrate durante l’intervento (o immediatamente dopo, in una variante del metodo). Questa tecnica, però, ha dimostrato di poter sostituire la RT frazionata (cioè la modalità “classica”) solo nelle pazienti a bassissimo rischio di recidiva locale, ed al momento sembra essere solo un’ipotesi di studio, anche dove è praticata.
Effetti collaterali della RT
La somministrazione di radiazioni danneggia non solo le cellule tumorali, ma anche, in minor misura, quelle normali della mammella. Pertanto, in seguito alla RT possono manifestarsi:
Localmente: infiammazione, ulcerazioni, dolore, gonfiore (edema), arrossamento, colorazione scura della pelle (una sorta di abbronzatura che tende a perdurare a lungo), trasudazione della pelle;
A distanza: linfedema dell’arto superiore, che può gonfiarsi per il ristagno della linfa che non scorre più nei vasi linfatici dell’ascella. La RT è la causa più frequente di linfedema dell’arto superiore, e deve essere curato tempestivamente per limitare i danni che provoca soprattutto alla funzione dell’arto superiore.
In generale: senso di prostrazione e affaticamento (che passa gradualmente, una volta terminata la RT).
18. Le terapie farmacologiche adiuvanti (chemioterapia, terapia ormonale, terapia biologica)
Dopo la completa stadiazione della malattia può essere necessario ricorrere a terapie aggiuntive per migliorare il controllo locale ed evitare la comparsa di metastasi a distanza o ridurne l’attività.
In questa sede si fa riferimento alla terapia adiuvante precauzionale, cioè quella che segue un intervento chirurgico radicale, con o senza radioterapia.
I farmaci utilizzati per il cancro della mammella appartengono a tre categorie:
• i chemioterapici , che interferiscono con i meccanismi di replicazione del DNA cellulare;
• gli ormonoterapici, che bloccano lo stimolo degli estrogeni alla crescita delle cellule tumorali dotate di recettori;
• i farmaci biologici, che agiscono bloccando particolari recettori presenti sulle cellule tumorali.
Le caratteristiche cliniche e biologiche della malattia tumorale guidano la scelta di questi farmaci, che possono essere utilizzati con modalità differenti da paziente a paziente.
E’ possibile anche utilizzare le terapie farmacologiche (soprattutto la chemioterapia) prima dell’intervento chirurgico e della radioterapia per ridurre la massa tumorale e consentire un intervento radicale ed il più possibile conservativo (capace di togliere il tumore con la minore perdita di tessuti possibile). Questo uso dei farmaci è detto terapia neoadiuvante.
L’utilizzazione più frequente è dopo l’intervento chirurgico, sia con l’intento di eliminare metastasi a distanza (terapia del carcinoma metastatico), sia per prevenire la diffusione della malattia a partire da eventuali nidi cellulari tumorali residui (terapia adiuvante precauzionale).
Anche l’intervento chirurgico più esteso, infatti, può lasciare una piccola quota di cellule che formeranno la recidiva locoregionale (limitata alla sede dell’intervento). Inoltre, una certa quantità di cellule tumorali “viaggia” nel torrente sanguino e tende ad annidarsi in organi distanti (cervello, polmone, fegato, surreni, ossa, ecc.), dove vengono per la massima parte distrutte dalle difese naturali. La terapia adiuvante precauzionale è rivolta proprio contro quelle cellule tumorali viaggiatrici, in modo da distruggerle prima che formino metastasi.
CHEMIOTERAPICI
Appartengono a molteplici classi farmacologiche e normalmente vengono somministrati secondo precisi schemi di terapia, calibrati sulle caratteristiche del tumore e sulla tollerabilità.
E’ in fase di studio una nuova modalità di somministrazione dei chemioterapici a piccole dosi ed in modo continuativo (terapia metronomica), preferibilmente per bocca. Lo scopo di questa modalità di cura è la riduzione degli effetti collaterali, mantenendo la stessa efficacia antitumorale.
Nella tabella, tratta da http://www.senologia.it/images/pdf/Terapia%20Medica%202012.pdf , sono riportati gli schemi di chemioterapia attualmente in uso.
5-Fluorouracile
Adriamicina
Ciclofosfamide |
500 e.v.
50 e.v.
500 e.v. |
1° e 8°
1°
1° e 8° |
Ogni 21 o ogni 28 giorni
|
5-Fluorouracile
Epirubicina
Ciclofosfamide |
500 e.v.
60 e.v.
500 e.v. |
1° e 8°
1°
1° e 8° |
Ogni 21 o ogni 28 giorni
|
Adriamicina o
Epirubicina
Ciclofosfamide |
50 – 60 e.v.
75 e.v.
600 e.v. |
1°
1°
1° |
Ogni 21 giorni
|
Adriblastina
Taxolo |
50 – 60 e.v.
200 e.v. |
1°
1° |
Ogni 21 giorni
|
Epirubicina
Taxolo |
75 – 90 e.v.
200 e.v. |
1°
1° |
Ogni 21 giorni
|
Adriblastina
Taxotere |
50 e.v.
75 e.v. |
1°
1° |
Ogni 21 giorni
|
Epirubicina
Taxotere |
75 e.v.
75 e.v. |
1°
1° |
Ogni 21 giorni
|
Capecitabina
Taxotere |
2500 os
75 e.v. |
Dal 1° al 14°
1° |
Ogni 21 giorni
|
Adriblastina
Vinorelbina |
50 e.v.
25 e.v. |
1°
1° e 8° |
Ogni 21 giorni
|
Epirubicina
Vinorelbina |
60 e.v.
25 e.v. |
1°
1° e 8° |
Ogni 21 giorni
|
Capecitabina
Vinorelbina |
2000 os
55 os
25 e.v. |
Dal 1° al 14°
1° e 8°
1° e 8° (o 3°) |
Ogni 21 giorni
|
Ciclofosfamide
Methotrexate
5-Fluorouracile |
100 os
40 e.v.
600 e.v. |
Dal 1° al 14°
1° e 8°
1° e 8° |
Ogni 28 giorni
|
Ciclofosfamide
Methotrexate
5-Fluorouracile |
600 e.v.
40 e.v.
600 e.v. |
1°
1°
1° |
Ogni 21 giorni
|
Ciclofosfamide
Methotrexate
5-Fluorouracile |
600 e.v.
40 e.v.
600 e.v. |
1° e 8°
1° e 8°
1° e 8° |
Ogni 21 giorni
|
Gli effetti collaterali della chemioterapia possono essere acuti (entro poche ore dalla somministrazione), ritardati (entro pochi giorni) o cronici (a distanza di mesi o anni).
I più noti degli effetti collaterali acuti sono nausea e vomito, che attualmente sono molto ben contrastati dagli antiemetici antagonisti della serotonina (ondansetrone, granisetrone, tropisetrone, dolasetrone, palosetrone)
Tra gli effetti collaterali ritardati, la riduzione dei globuli bianchi (leucopenia) e delle piastrine (piastrinopenia o trombocitopenia) che avviene tra l’8° e il 12° giorno. Il ritorno alla normalità avviene tra il 20° e il 28° giorno. Talora può associarsi anche la riduzione dei globuli rossi (anemia).
Il più noto degli effetti collaterali ritardati è la perdita dei capelli e delle sopracciglia, che si manifesta nel corso del secondo mese di terapia. Al termine dei cicli di chemioterapia, la ricrescita è completa.
Anche il senso di affaticamento (astenia) può manifestarsi dopo alcuni giorni dall’inizio della chemioterapia e scompare con gradualità nei mesi successivi al termine della terapia.
Tra gli effetti collaterali cronici, l’arrossamento delle palme delle mani e delle piante dei piedi con parestesie (eritrodisestesia), la possibile tossicità cardiaca e neurologica, caratteristica di alcuni farmaci, il cui uso è, perciò, soggetto a particolari precauzioni.
TERAPIA ENDOCRINA
Molti tumori della mammella sono sensibili all’azione degli ormoni femminili, che ne stimolano la crescita.
Contro questi tipi di tumori vengono utilizzati farmaci capaci di impedire che gli estrogeni normalmente prodotti dall’organismo, stimolino la moltiplicazione delle cellule cancerose.
Le classi di farmaci utilizzate per la terapia ormonale adiuvante precauzionale sono: gli LH-RH analoghi, gli antiestrogeni, gli inibitori delle aromatasi.
La terapia ormonale adiuvante precauzionale viene protratta per cinque anni.
Il tipo di farmaci utilizzati dipende anche dal fatto che la donna sia in età fertile, in premenopausa o già in menopausa.
1. Donne in età fertile.
Sono indicati farmaci che hanno l’effetto di ridurre progressivamente la secrezione di ormoni femminili da parte delle ovaie. L’effetto di questi farmaci è di indurre una menopausa farmacologica totalmente reversibile al termine della terapia.
Pertanto, la donna che ha terminato il trattamento con questi farmaci torna fertile.
Sono farmaci che agiscono come l’ormone che rilascia l’ormone luteinizzante: è come se la donna si trovasse costantemente nella fase luteinizzante del ciclo, cioè quella in cui le ovaie non producono più gli estrogeni. Sono detti LH-RH analoghi.
Gli effetti collaterali sono i disturbi tipicamente legati all’ingresso in menopausa: vampate di calore al volto, cefalea, spotting vaginale, eruzioni cutanee, ipercolesterolemia.
2. Donne in premenopausa e postmenopausa.
Tamoxifene
Il più usato e più noto farmaco capace di bloccare i recettori per gli estrogeni presenti sulle cellule cancerose è il tamoxifene (TAM). E’ anche il farmaco per il quale esiste la maggiore esperienza d’uso.
Gli effetti collaterali minori sono vampate di calore e prurito vulvare. In circa il 5-10% dei casi, nelle prime due o tre settimane può manifestarsi il cosiddetto tumor flare, cioè un aumento dei disturbi causati dal tumore (dolori ossei, ipercalcemia, lesioni cutanee); questo fenomeno cessa spontaneamente e non interferisce con l’efficacia della cura. Possono verificarsi anche tromboflebiti e riduzione del numero delle piastrine.
Gli effetti collaterali maggiori si possono presentare nei trattamenti di lungo termine (anni). Riguardano il fegato, con un aumento delle transaminasi, e la possibilità che si sviluppi un adenocarcinoma dell’endometrio. Per questo, durante la terapia con TAM, si effettuano controlli periodici sia degli enzimi del fegato (ogni sei mesi) sia dello stato dell’endometrio attraverso periodiche ecografie transvaginali.
Il TAM può essere somministrato anche in donne in età fertile, con l’avvertenza che non ha effetto anticoncezionale. La gravidanza è sconsigliata perché presuppone l’interruzione dell’assunzione di TAM.
3. Donne in postmenopausa.
Fulvestrant
E’ un farmaco che agisce in modo simile al TAM, bloccando e distruggendo i recettori per gli estrogeni delle cellule cancerose. Ha anche una certa azione di riduzione dei recettori per il progesterone.
Viene usato quando il TAM non riesce a mantenere sotto controllo eventuali metastasi (farmaco di seconda linea).
Inibitori dell’aromatasi
L’aromatasi è l’enzima (proteina che influenza i processi biochimici) che permette la trasformazione del testosterone in estradiolo ed è presente in grande quantità in quasi tutti i carcinomi della mammella, in cui la concentrazione di estrogeni è elevata.
Se questo enzima viene bloccato, si arresta la produzione di estrogeni e, quindi, le cellule tumorali sensibili a questi ormoni non vengono più stimolate a crescere. La loro azione biologica è, quindi, il blocco totale della produzione di estrogeni.
Attualmente si utilizzano gli inibitori dell’aromatasi di terza generazione, che possono essere somministrati per bocca e non interferiscono nella produzione degli ormoni surrenalici cortisolo e aldosterone, che governano funzioni metaboliche essenziali.
Gli inibitori dell’aromatasi di terza generazione sono: Letrozolo (Femara), utilizzato anche nel tumore dell’ovaio; Exemestane (Aromasin); Anastrozolo (Arimidex)
L’effetto collaterale più importante della terapia con inibitori dell’aromatasi è l’osteoporosi, che può essere prevenuta con la somministrazione di farmaci bifosfonati (p.es. alendronato).
Progestinici
Appartengono anch’essi alle terapie ormonali e vengono utilizzati come farmaci di terza linea, quando il tumore non risponde più ad antiestrogeni e inibitori dell’aromatasi.
I più utilizzati sono medrossiprogesterone acetato (MAP) e megestrolo acetato (MA): agiscono direttamente sulla cellula tumorale e indirettamente sopprimendo gli estrogeni.
Gli effetti collaterali sono numerosi: gastralgie, ipertensione, aumento del peso corporeo, iperglicemia, irsutismo.
Nella tabella sono riportati i farmaci più usati nella terapia ormonale.
| Farmaco |
Dose e via di somministrazione |
Giorni |
Periodicità |
| |
|
|
3,6 mg s.c.
3,75 mg i.m.
3,75 mg i.m. |
1°
1°
1° |
Ogni 28 giorni
Ogni 28 giorni
Ogni 28 giorni |
| |
|
|
20 mg per os
250 mg i.m. |
Tutti i giorni
1° |
Ogni 28 giorni |
| |
|
|
2,5 mg per os
1 mg per os
25 mg per os |
Tutti i giorni
Tutti i giorni
Tutti i giorni |
|
| |
|
|
Da 1000 a 15000 mg per os
500 mg i.m.
160 mg per os |
Dal 1° al 20° giorno
Tutti i giorni
Tutti i giorni |
Ogni 28 giorni
|
TERAPIA BIOLOGICA
I farmaci biologici agiscono su bersagli specifici presenti sulle cellule tumorali, oppure su fattori di crescita che favoriscono la crescita e diffusione del tumore.
Se i bersagli cui sono diretti questi farmaci non sono presenti nel tessuto tumorale, però, la loro efficacia è nulla, quindi vengono usati in pazienti accuratamente selezionate.
Trastuzumab
E’ un anticorpo monoclonale che agisce contro la proteina Her2/neu che è presente in circa il 25% dei tumori della mammella. L’uso in associazione con chemioterapia o terapia ormonale (nei casi in cui il tumore sia sensibile agli estrogeni) ne potenzia l’efficacia, sia nella terapia adiuvante che nella terapia neoadiuvante.
Lapatinib
E’ una molecola in grado di bloccare sia il recettore del fattore di crescita epiteliale (EGFR), sia il recettore Her2/neu e si è dimostrato efficace in una quota importante di pazienti che non rispondono più al Trastuzumab.
Bevacizumab
E’ un anticorpo monoclonale che agisce contro il fattore di crescita dell’endotelio vascolare (VEGF), che stimola la formazione di vasi sanguigni: poiché il tumore ha un grande bisogno di questo fattore di crescita, il bevacizumab priva il tumore della sua capacità di nutrire le proprie cellule. Anche questo anticorpo viene utilizzato in particolari associazioni con chemioterapici, particolarmente in caso di metastasi a distanza. Peraltro i suoi effetti collaterali possono essere gravi: ipertensione, trombosi, sanguinamenti.
19. Fonti principali
Forza Operativa Nazionale sul Carcinoma Mammario - Linee guida (http://www.senologia.it/index.php/f-o-n-ca-m/linee-guida) (Italia)
National Cancer Institute (http://www.cancer.gov/) (USA)
National Health Service (http://www.nhs.uk/Conditions/Cancer-of-the-breast-female) (UK)
Ministero della Salute (http://www.salute.gov.it/portale/salute/p1_2.html) (Italia)
Singhal H, Schraga ED: Axillary dissection; 26 settembre 2013: http://emedicine.medscape.com/article/1894763-overview (UK)